ENFERMEDAD DE GRAVES
INTRODUCCIÓN
La Enfermedad de Graves es un trastorno autoinmune sistémico caracterizado por infiltración de células T específicas del antígeno tiroideo en los tejidos que expresan el receptor para la hormona estimulante de tiroides (R-TSH).
Los autoanticuerpos estimulantes activan el receptor de TSH que conduce a hiperplasia tiroidea y a la producción y secreción no regulada de hormona tiroidea.
EPIDEMIOLOGÍA Y PATOGENIA
Las hormonas tiroideas aumentan la termogénesis de los tejidos y la tasa metabólica basal, y reduce los niveles de colesterol en suero y la resistencia vascular sistémica.
Las complicaciones del hipertiroidismo no tratado incluyen perdida anormal de peso, osteoporosis, fracturas por fragilidad, fibrilación auricular, eventos embólicos y disfunción cardiovascular.
La prevalencia del hipertiroidismo es del 1.2 a 1.6 por ciento en total, 0.5 a 0.6 % para hipertiroidismo manifiesto y 0.7 a 1 % subclínico. Las causas más frecuentes son enfermedad de graves y bocio nodular toxico.
La Enfermedad de Graves es la causa más frecuente de hipertiroidismo en áreas geográficas sin carencia de yodo, con 20 a 30 casos por cada 100 000 personas al año.
La Enfermedad de Graves es más frecuente en mujeres y su prevalencia poblacional es del 1 a 1.5%.
3% de las mujeres y 0.5% de los hombres desarrollan Enfermedad de Graves en su vida. La incidencia máxima se observa en los 30 a 60 años, y en afroamericanos.
Para más contenido visita mi canal de youtube: YOUTUBE
La Enfermedad de Graves es una enfermedad autoinmune especifica de un órgano cuyas principales manifestaciones se deben a los autoanticuerpos circulantes que estimulan el receptor de TSH (R-TSH), lo que conduce a hipertiroidismo y bocio. Los anticuerpos son principalmente del isotipo IgG1.
La unión de los anticuerpos al R-TSH mejora la producción de AMP cíclico intracelular lo que conduce a la liberación de hormonas tiroideas y al crecimiento de la glándula.
Alrededor de 30% de los pacientes con Enfermedad de Graves tienen familiares con tiroidopatía autoinmune (Graves o Hashimoto).
Estudios con gemelos han demostrado que el 80% de la susceptibilidad es genética.
Relacionada con HLA-DR3 Y HLA-DR4, otros locis afectos: antígeno 4 de linfocitos T citotóxicos, el no receptor de proteína tirosina fosfatasa 22, el factor de transcripción básico de cremallera de leucina 2 y CD40.
Los factores ambientales, como el tabaquismo, el alto consumo de yodo en la dieta, el estrés y el embarazo, también predisponen.
El uso de la píldora anticonceptiva oral parece protector, al igual que el sexo masculino, lo que sugiere una fuerte influencia de las hormonas sexuales.
DIAGNÓSTICO
La medición de TSH en suero tiene la mayor sensibilidad y especificidad de cualquier análisis de sangre utilizado en la evaluación de sospecha de hipertiroidismo y debe utilizarse como prueba de detección inicial.
La precisión diagnóstica mejora cuando se evalúan tanto la TSH sérica como la T4 libre.
La relación entre T4 libre y TSH (cuando el eje pituitario-tiroideo está intacto) es una relación logarítmica lineal inversa; por lo tanto, pequeños cambios en T4 libre resultan en grandes cambios en las concentraciones séricas de TSH.
En el hipertiroidismo manifiesto, las concentraciones de T4 y T3 libres de suero están elevadas y se suprime la TSH sérica; sin embargo, en el hipertiroidismo leve, los niveles séricos totales de T4 y T4 libre pueden ser normales, solo la T3 libre en suero puede estar elevada, con una TSH sérica indetectable.
Los autoanticuerpos activadores del receptor de TSH son biomarcadores específicos para la enfermedad de graves, los inmunoensayos actuales utilizan un ensayo de unión competitiva y miden lo que se conoce como inmunoglobulinas inhibidoras de unión al receptor de TSH (TBII).
Los ensayos informan de la presencia y concentración de los TSH-R-anticuerpo, pero no de su funcionalidad, tienen una sensibilidad y especificidad del 97 y 98 % respectivamente.
En contraste, los bioensayos altamente sensibles basados en células diferencian exclusivamente entre el anticuerpo estimulante de TSH-R (TSAB) y el anticuerpo de bloqueo de TSH-R. Además, TSAB es un biomarcador altamente sensible y predictivo para las manifestaciones extratiroideas de la enfermedad de graves, así como una medida predictiva útil de hipertiroidismo fetal o neonatal.
La incorporación y utilización temprana de TSAB en los algoritmos de diagnóstico actuales confirió un tiempo acortado del 46% para el diagnóstico de dg y un ahorro de costos del 47%.
IMAGEN
En un estudio americano sobre el uso de herramientas imagenológicas se encontró que se usó ultrasonido en el 93.8% de los pacientes y gammagrafía en el 40.3%.
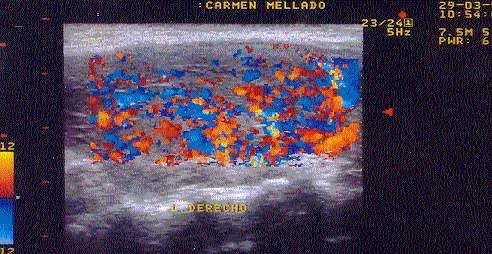
El USG es una técnica no invasiva, barata, rápida y precisa en la evaluación inicial de los pacientes con enfermedad de graves, que también ayuda a determinar la etiología subyacente de la tirotoxicosis y detectar los nódulos tiroideos concomitantes. Al aplicar Doppler se puede encontrar el signo llamado infierno tiroideo.
La medición precisa de la velocidad del flujo de la arteria tiroidea y la velocidad sistólica máxima (PSV) requiere ajustes de la frecuencia de repetición de pulso de los filtros de pared y el control del ángulo de insonación entre 0 y 60°. En Enfermedad de Graves no tratada, la velocidad de flujo de la arteria tiroidea y el PSV aumentan significativamente. El PSV puede diferenciar entre tirotoxicosis debido a Enfermedad de Graves de tiroiditis subaguda o tirotoxicosis inducida por amiodarona tipo 2, donde el flujo sanguíneo se reduce.
La gammagrafía tiroidea puede ser útil en la evaluación de pacientes antes del tratamiento con yodo radiactivo, especialmente cuando se enfrentan al bocio multinodular coexistente.
TRATAMIENTO
El hipertiroidismo se trata reduciendo la síntesis de hormonas tiroideas, utilizando drogas antitiroideas, con yodo radioactivo o con cirugía.
La terapia preferida es con drogas en los Estados Unidos, Europa y Asia.
Para más contenido visita mi canal de youtube: YOUTUBE
DROGAS ANTITIROIDEAS (DAT)
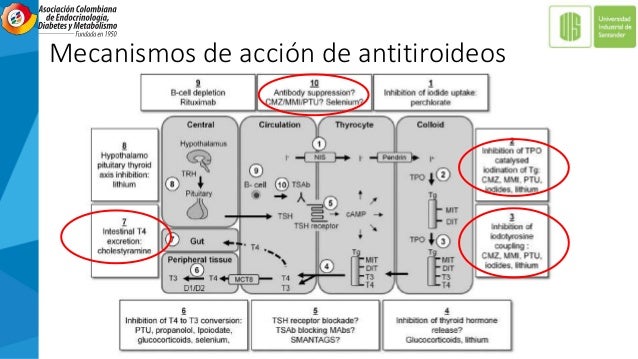
Las principales drogas antitiroideas son las tionamidas como el propiltiouracilo, el carbimazol, metimazol/tiamazol, el carbimazol es una molécula no activa que se convierte en metimazol/tiamazol, para que esto suceda debe ser descarboxilado en el hígado.
Su mecanismo de acción es inhibiendo el acoplamiento de yodotironinas y por lo tanto reducen la síntesis de hormonas tiroideas, también inhiben la función de la tioperoxidasa, reduciendo la oxidación y organificación del yoduro, están indicados como terapia de primera línea y particularmente en los más jóvenes y previo a los que se realizara radioterapia o tiroidectomía.
Los antitiroideos también reducen los anticuerpos-TSH-R y aumenta las tasas de remisión.
El propiltiouracilo (PTU) a dosis mayores inhibe la desyodación de t3 a t4 por lo que es usado en tormenta tiroidea.
Dosis inicial del tiamazol/metimazol es de 10 a 30 mg vo cada 24 hrs en una sola toma o dividida.
PTU 100 mg c 8 hrs.
Todos deben ajustarse cada 4 a 6 semanas en base a niveles de t4 libre, la mayoría alcanza el estado eutiroideo en este tiempo.
Dosis de mantenimiento: tiamazol 2.5 a 10 mg, ptu 20 a 100 mg.
Existe otro tratamiento que se llama bloqueo-sustitución para tratar el hipotiroidismo causado por las drogas antitiroideas.
La duración óptima de la terapia con DAT para el régimen de valoración es de 12 a 18 meses.
Las tasas máximas de remisión (50–55%) se alcanzan dentro de los 12–18 meses. Se recomienda medir los niveles de TSH-R-Anticuerpo antes de suspender la terapia con DAT, ya que ayuda a predecir qué pacientes pueden ser destetados de la medicación, con niveles normales que indican una mayor probabilidad de remisión.
Los pacientes con TSH-R-Anticuerpo persistentemente alto a los 12-18 meses pueden continuar la terapia con tiamazol, repitiendo la medición de TSH-R-Anticuerpo después de 12 meses adicionales u optar por iodo radioactivo o tiroidectomía.
La recaída es más probable dentro de los primeros 6 a 12 meses después de la abstinencia de DAT, pero puede ocurrir años más tarde.
Los pacientes con hipertiroidismo severo, bocios grandes o títulos altos persistentes de TSH-R-Anticuerpo tienen más probabilidades de recaer cuando se suspende el tratamiento, pero el resultado es difícil de predecir. Todos los pacientes deben ser seguidos de cerca por recaídas durante el primer año después del tratamiento y al menos anualmente a partir de entonces.
Para más contenido visita mi canal de youtube: YOUTUBE
EVENTOS ADVERSOS
Los más comunes son erupción o rash cutáneo, urticaria/prurito y artralgias (1-5%), las reacciones cutáneas se tratan con terapia antihistamínica sin detener las tionamidas. En caso de reacción adversa grave suspender tionamidas y preferir cirugía o radioterapia.
Efectos graves hepatitis, síndrome de lupus-like en 0.1 a 1% de los casos, agranulocitosis en los primeros 3 meses (faringitis, fiebre y ulceras orales) 0.29%. Los determinantes genéticos de la agranulocitosis inducida por DAT han demostrado que los alelos HLA-B *38:02 Y HLA-DRB1 *08:03 son loci de susceptibilidad independientes para la agranulocitosis. Llevar tanto HLA-B *38:02 como HLA-DRB1 *08:03 aumenta la razón de posibilidades a 48.41%.
La hepatotoxicidad asociada a PTU ocurre principalmente en niños en contraste con la asociada con tiamazol, que generalmente es más leve con un patrón colestásico.
BETA-BLOQUEO
Propranolol 20-40 mg c 6 hrs (atenolol-bisoprolol) útiles para controlar síntomas adrenérgicos como palpitaciones y temblor, también a dosis altas de propranolol 40 mg vo c 6 hrs inhiben la conversión periférica de t3 a t4.
RECAIDA DESPUES DEL CICLO CON TIONAMIDAS
52.7% y de 15% para radioyodo y 10% cirugía.
La orbitopatía, el tabaquismo, el volumen tiroideo, la t4 libre, la t3 total y la TSH-R-Anticuerpos se asociaron significativamente con la recaída.
El 37% de los pacientes con un primer episodio de hipertiroidismo de graves recayeron dentro de los 2 años posteriores a la abstinencia de DAT. Menor edad, mayor TSH-R-Anticuerpos en suero y t4 libre, bocios más grandes en el momento del diagnóstico, polimorfismo PTPN22 C/T y subtipos HLA-DQB1*02, DQA1*05 Y DRB1*03 fueron predictores independientes de recurrencia.
La disfunción tiroidea fue predominante en el grupo radioyodo (p <0.001), y el eutiroidismo fue más común en el grupo tiamazol.
El deterioro de la orbitopatía de graves fue mayor después de la rai (p <0.0005) durante todos los períodos de seguimiento (p <0.0003). Los pacientes ganaron más peso después de la radioyodo (p<0,005). Por lo tanto, las dosis bajas de tiamazol fueron eficientes, seguras y ofrecieron mejores resultados para orbitopatía de graves que el tratamiento con radioyodo.
HIPERTIROIDISMO SUBCLÍNICO
El hipertiroidismo endógeno leve o subclínico se asocia con un mayor riesgo de mortalidad por enfermedad coronaria, fibrilación auricular incidente, insuficiencia cardíaca, fracturas y exceso de mortalidad en pacientes con niveles séricos de TSH <0.1 mui / l.
En presencia de TSH-R-Anticuerpos que indica Enfermedad de Graves "subclínica", la tasa de progresión al hipertiroidismo manifiesto es de hasta el 30% en los 3 años posteriores.
El tratamiento del hipertiroidismo subclínico está indicado en mayores de 65 años con una TSH que es persistentemente <0.1 mui / l para evitar potencialmente estos eventos adversos graves y el riesgo de progresión a hipertiroidismo manifiesto.
TORMENTA TIROIDEA
Tasa de mortalidad del 10 al 30 %.
Se manifiesta por disfunción orgánica múltiple, estado mental alterado, fiebre, insuficiencia cardiaca, diarrea e ictericia.
Los criterios de diagnóstico para la tormenta tiroidea en pacientes con tirotoxicosis grave de graves incluyen hiperpirexia, taquicardia, arritmia, insuficiencia cardíaca congestiva, agitación, delirio, psicosis, estupor, coma, náuseas, vómitos, diarrea, insuficiencia hepática y la presencia de un precipitante identificado.
El sistema de "escala de puntos de burch-wartofsky" califica la gravedad de las manifestaciones individuales, con un total de puntos ≥45 consistentes con tormenta tiroidea, 25–44 puntos clasificados como tormenta tiroidea inminente y <25 puntos indicando que la tormenta tiroidea es poco probable.
Para más contenido visita mi canal de youtube: YOUTUBE
TRATAMIENTO
PTU (40 o 400 mg cada 8 h), glucocorticoides (metilprednisolona 50 mg IV), betabloqueantes (propranolol 40 mg cada 6 h), y monitoreo en una unidad de cuidados intensivos.
La causa más común de muerte por tormenta tiroidea fue insuficiencia orgánica múltiple, seguida de insuficiencia cardíaca y respiratoria, arritmia, coagulación intravascular diseminada, perforación gastrointestinal, síndrome cerebral hipóxico y sepsis.
IODO RADIOACTIVO
Desde 1941.
El efecto celular de la radiación ionizante causa daño genético, mutaciones y muerte celular, el daño al ADN es causado por la ruptura de enlaces moleculares y formación de radicales libres.
Esto conduce a una disminución de la función tiroidea y / o una reducción del tamaño de la tiroides. No existen buenas medidas de radiosensibilidad individual ni métodos ideales para predecir la respuesta clínica a la terapia.
INDICACIONES Y DOSIS
Los pacientes con efectos secundarios o recurrencia después de un curso de DAT, arritmias cardíacas y parálisis periódica tirotóxica son candidatos para la rai.
El radioyodo está contraindicada en el embarazo y durante la lactancia, y la concepción debe posponerse hasta al menos 6 meses después de la terapia.
El mismo período de 6 meses se aplica a los hombres.
ALARA (tan bajo como sea razonablemente posible) es un principio importante con el tratamiento con radiación, pero un objetivo difícil de alcanzar al equilibrar el alivio rápido del hipertiroidismo y posponer el hipotiroidismo.
por lo tanto, muchos han abandonado el cálculo meticuloso de la dosis y ofrecen actividades fijas de, por ejemplo, 185, 370 o 555 mbq (5, 10 y 15 mcui), basadas en parámetros clínicos validados, como el tamaño de la tiroides.
La función tiroidea se normaliza dentro de los 3 a 12 meses posteriores al tratamiento con radioyodo en 50 a 90% de los pacientes.
La tasa de incidencia de hipotiroidismo es del 5 al 50% después del primer año.
Esto es seguido por una tasa anual de hipotiroidismo de 3 a 5%, que es en gran medida independiente de la dosis de radioyodo.
El tamaño de la tiroides se normaliza dentro de un año de la radioyodo.
Los tionamidas deben suspenderse una semana antes y después de la radioterapia con iodo.
EFECTOS ADVERSOS
Dolor de tiroides, hinchazón y sialoadenitis. La tormenta tiroidea posterior a la terapia es extremadamente rara.
Si la tirotoxicosis no ha mejorado después de 3 meses, es probable que falle el tratamiento.
El hipotiroidismo transitorio se observa en 3 a 20% de los casos y no siempre conduce a un hipotiroidismo permanente, pero generalmente se recomienda el tratamiento con hormonas tiroideas para evitar el desarrollo o un brote de orbitopatía de graves. Los glucocorticoides profilácticos previenen esto sin influir en el resultado final de la función tiroidea.
Para más contenido visita mi canal de youtube: YOUTUBE
CIRUGÍA
La cirugía representó el tratamiento de primera línea en 0.9% EUA y 2.1% Europa.
La tiroidectomía es un tratamiento eficaz cuando el bocio es grande, hay hiperparatiroidismo primario coincidente o sospecha de nódulos malignos, el paciente desea evitar la exposición a DAT o radioyodo.
Si se selecciona la cirugía, la tiroidectomía total es el procedimiento de elección, ya que conlleva el mismo riesgo de complicaciones que la tiroidectomía subtotal bilateral, mientras que la tasa de hipertiroidismo recurrente es menor.
El uso de una solución saturada de yoduro de potasio (sski) es útil en el período preoperatorio inmediato (10 días) para disminuir la vascularización de la tiroides y la pérdida de sangre intraoperatoria.
TRATAMIENTO DEL HIPERTIROIDISMO DE GRAVES EN PACIENTES CON ORBITOPATÍA
Directriz ETA/EUGOGO-ADEMS del consenso italiano recomendó llevar al eutiroidismo y mantenerlo lo más rápido posible y de manera prioritaria en el paciente con orbitopatia de graves.
DAT per se no influye en el curso natural de orbitopatia de graves, pero podría ser beneficioso para orbitopatia de graves indirectamente, como consecuencia de la restauración del eutiroidismo. El hipotiroidismo también puede causar la progresión de orbitopatia de graves. RADIOYODO provoca la progresión o la aparición de novo de orbitopatia de graves, particularmente en fumadores, aquellos con preexistencia e inicio reciente, corrección tardía del hipotiroidismo post-radioyodo y niveles altos de TSH-R-Anticuerpos.
Darle pulsos de esteroide metilprednisolona 500 mg iv c semana por 6 semanas luego 250 mg iv cada semana por 6 semanas.
EMBARAZO Y ENFERMEDAD DE GRAVES
Para embarazarse debe encontrarse en eutiroidismo en dos determinaciones de t4 libre en intervalos de 2 meses.
La dosis diaria inicial de DAT depende de la gravedad del hipertiroidismo: tiamazol 5–15 mg, carbimazol 10–30 mg, propiltiouracilo 50–200 mg.
El riesgo de recurrencia de enfermedad de graves fue más alto 7–9 meses después del parto (rr 3.8) en estudios realizados en Dinamarca y japón. Solo pequeñas cantidades de DAT entran en la leche materna, y las dosis bajas de PTU (<250 mg) y tiamazol (<20 mg) se consideran seguras para la madre y el niño. DAT debe tomarse después de haber amamantado al niño y en dosis divididas.
Para más contenido visita mi canal de youtube: YOUTUBE
LA EMBRIOPATÍA POR TIAMAZOL
Incluye facies dismórfica, aplasia cutis, atresia coanal o esofágica, defectos de la pared abdominal, umbilicocele y defectos del tabique ventricular, afecta al 2–4% de los niños que han estado expuestos a tiamazol, especialmente durante las semanas gestacionales 6–10.
Más recursos para estudiar:
Ya conoces UpToDate?